بررسی موتاسیون های ژن JAK2
تشخیص CML به روش RT-PCR

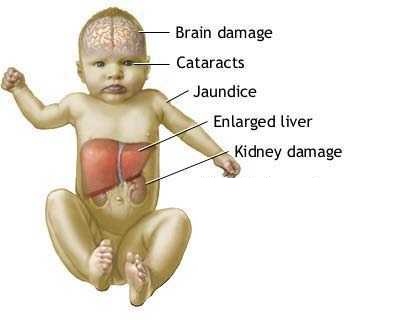
موکوپلی ساکاریدوز نوع دو یا هانتر (Mucopolysaccharidosis type II or Hunter=MPS II)
موکوپلی ساکاریدوز نوع II که سندروم هانتر نیز نامیده می شود، حالتی است که قسمت های متعددی از بدن را تحت تآثیر قرار می دهد و معمولآ در مردان دیده می شود. این بیماری موجب ناتوانی پیشرونده در افراد می شود ولی میزان پیشرفت آن در افراد مختلف ممکن است متفاوت باشد.
در موقع تولد نوزادان مبتلا علائم چندانی بروز نمی دهند. بین دو تا چهار سالگی علائمی مثل: لب های کلفت، لپ های بزرگ، بینی پهن و زبان بزرگ نمودار می شوند. همچنین تارهای صوتی بزرگ شده و منجر به صدای بم و خشن می شود. تنگ شدن راههای هوایی موجب عفونت های مکرر قسمت فوقانی ریه و وقفه های کوتاه تنفسی در موقع خواب می شود. با پیشرفت بیماری کودکان مبتلا نیاز به کمک های پزشکی برای باز نگاه داشتن راههای تنفسی پیدا می کنند.
تعداد دیگری از بافتها و اندامها نیز در این بیماری درگیر می شوند. افراد مبتلا به بیماری هانتر اغلب دارای سر بزرگ (ماکروسفالی)، تشکیل مایعات در مغز (هیدروسفالی)، بزرگی کبد و طحال (هپاتواسپلینومگالی) و فتق نافی هستند. افراد مبتلا به بیماری معمولآ دارای پوست کلفت هستند که از قابلیت انعطاف کمی برخوردار است و گاهآ لکه های ریز سفید رنگ در آن دیده می شود. بسیاری از افراد بیمار به ناشنوایی مبتلا می شوند و عفونت های مکرر گوش در آنها شایع است. در برخی از بیمااران در شبکیه که بافتی حساس به نور در قسمت خلفی گوش است پیش می آید که باعث ضعف بینایی می شود. سندروم تنگی تونل کارپال در کودکان مبتلا بسیار شایع است که موجب کرختی . ضعف انگشتان دست می شود. تنگی کانال نخاعی در ناحیه گردن ممکن است موجب فشار بر نخاع در این ناحیه و آسیب آن بشود. اختلالات قلبی نیز در این افراد بسیار شایع است و بسیاری از آنها به مشکلات دریچه قلب دچار می شوند. اختلال دریچه قلب ممکن است موجب بزرگ شدن عضله قلب و نارسایی قلبی شود.
کودکان مبتلا تا ۵ سالگی به طور پیوسته رشد می کنند، سپس رشدشان کند می شود و موجب کوتاهی قد می گردد. این افراد دارای بدشکلی های مفصلی هستند که به شدت حرکت آنها را مختل می کند. اختلالات اسکلتی از جمله دیگر علائمی است که موجب کلف تر شدن استخوان های دراز به خصوص دنده ها می شود و با رادیوگرافی قابل تشخیص است.
موکوپلی ساکاریدوز تیپ دو خود دارای دو نوع است: نوع شدید و نوع خفیف که در هر دو اندامهای متعددی درگیر می شوند. افراد مبتلا به نوع شدید بیماری به زوال عقلی مبتلا می شوند و سرعت پیشرفت این نوع از بیماری زیاد است به نوعی که مهارتهای عملی خود را بین ۶ تا ۸ سالگی از دست می دهند و طول عمر آنها ۱۰ تا ۲۰ سال است. افراد مبتلا به نوع خفیف بیماری نیز طول عمر کمتری دارند ولی معمولآ تا سن بلوغ زنده می مانند و مشکل زوال عقلی در آنها دیده نمی شود. بیماری قلبی و انسداد راههای تنفسی دلیل اصلی فوت این افراد است.
میزان شیوع بیماری: این بیماری از هر ۱۰۰ تا ۱۷۰ هزار فرد مذکر یک نفر را مبتلا می کند.
علت بیماری: جهش در ژن IDS موجب بیماری می شود. ژن فوق اطلاعات لازم برای تولید آنزیم ۱۲S را ارائه می دهد که درشکستن مولکول قندی به نام گلایکوزآمینوگلایکان ها که قبلآ موکوپلی ساکارید نامیده می شد شرکت می کند. جهش در ژن IDS موجب کاهش یا فقدان کامل عملکرد آنزیم ۱۲S می شود. این موضوع باعث تجمع گلایکوزآمینوگلایکان ها در درون سلولها بخصوص درون لیزوزومها می گردد. . لیزوزومها اجزاء درون سلولی هستند که موجب هضم و تصفیه مواد می شوند. به حالاتی نظیر MPSII که موجب انباشته شدن مولکولها درون لیزوزومها می شوند بیماریهای ذخیره ای لیزوزوم گفته می شود. تجمع گلیکوزآمینوگلایکان ها در داخل لیزوزوم منجر به بزرگ شدن آن می شود و همین مسئله علت بزرگ شدن بسیاری از بافتها و ارگانها در این بیماریها می باشد. محققین همچنین معتقدند گلیکوز آمینوگلایکان ها در عین حال موجب جلوگیری از نفوذ مولکولها به درون سلول می شوند.
توارث بیماری: بیماری به صورت وابسته به X نهفته به ارث می رسد. ژن بیماریزا برروی کروموزوم X قرار دارد. با توجه به اینکه مردان فقط یک کروموزوم X دارند، وجود فقط یک ژن معیوب برروی تنها کروموزوم X آنها موجب ابتلاءشان خواهد شد. در صورتی که زنان دارای دو کروموزوم X می باشند و صرفآ زمانی مبتلا خواهند شد که هر دو ژن موجود برروی هر دو کروموزوم X معیوب باشند. به همین دلیل این بیماری اغلب در افراد مذکر دیده می شود و زنان معمولآ ناقل بیماری هستند.
تشخیص و پیشگیری
در صورتی که تمام یا برخی از علائم بیماری که در بالا به آنها اشاره شد در فرزند پسر یک خانم، یا برادر، پسر خواهر، دایی یا پسر خاله های او (هر فرد مذکری که با مادر خانم نسبت خونی داشته باشد) مشاهده شود، انجام موارد زیر حد اقل ۴ تا ۶ ماه پیش از اقدام به بارداری، برای پیشگیری از وقوع مجدد بیماری ضروری خواهد بود :
-
مراجعه به مرکز ژنتیک پزشکی برای تشخیص بیماری و تطبیق نحوه انتقال آن در فامیل با الگوی وراثتی بیماری.
-
تشخیص نوع جهش در ژن مسئول بیماری به یکی از روش های مولکولی در فرد مبتلای فامیل.
-
تعیین وضعیت مادر از حیث ناقل بودن یا نبودن برای جهش تشخیص داده شده در فرد مبتلا.
-
درصورتی که خانم ناقل ژن جهش یافته بیماری تشخیص داده شود احتمال وقوع بیماری در هر فرزند پسر او در هر بارداری ۵۰ درصد خواهد بود. در این صورت تشخیص پیش از تولد در هر بارداری ضرورت خواهد داشت. با توجه به اینکه بیماری به صورت وابسته به جنس مغلوب به ارث می رسد انتقال فقط یک نسخه از ژن جهش یافته به فرزندان پسر کافی است که او را مبتلا نماید. دختران این خانم اگر ژن معیوب را دریافت کنند ناقل بیماری خواهند بود.
-
مراجعه برای نمونه گیری برای تشخیص پیش از تولد. از دو نوع نمونه برای تشخیص پیش از تولد استفاده می شود:
-
نمونه CVS (پرزهای جفتی) که در هفته ۱۲ بارداری انجام می گیرد.
-
نمونه مایع آمنیوتیک که در هفته ۱۵ به بعد انجام می گیرد.
-
در موقع تشخیص پیش از تولد این بیماری، ابتدا جنسیت جنین مشخص می شود و در صورت مذکر بودن برای بیماری تست می شود.
-

موکوپلی ساکاریدوز نوع یک یا هورلر (Mucopolysaccharidosis type I or Hurler)
موکوپلی ساکاریدوز نوع I یا سندروم هورلر
بیماری است که بسیاری از اعضای بدن انسان را درگیر می کند و به دو شکل شدید و خفیف در بیماران تظاهر می یابد. کودکان مبتلا اغلب علائمی از بیماری را در حین تولد نشان نمی دهند، اگرجه برخی از آنها ممکن است فتق نافی یا فتق اینگوینال داشته باشند. افراد مبتلا به نوع شدید بیماری اغلب تا یک سالگی علائم را بروز می دهند، در حالیکه در نوع خفیف تر بیماری علائم ملایم تر است و در اواخر دوران کودکی ممکن است ظاهر شوند.
افراد مبتلا به هورلر ممکن است دارای سر بزرگ (ماکروسفالی)، تشکیل مایع در مغز (هیدروسفالی)، اختلال دریچه قلب، قیافه خشن، کبد و طحال بزرگ (هپاتواسپلینومگالی)، زبان بزرگ و همچنین طنابهای سوتی طویل که موجب بم و خشن شدن صدای افراد مبتلا می شود باشند. در برخی راههای صوتی تنگ است که موجب عفونت های مکرر قسمت فوقانی ریه و مشکلات تنفسی می شود.
در افراد مبتلا لایه پوشش دهنده چشم که در حالت نرمال کاملآ شفاف است (قرنیه) حالت کدر پیدا کند که می تواند باعث کاهش دید شدید شود. همچنین بیماران ممکن است از ضعف شنوایی و عفونت های مکرر گوش رنج ببرند.
برخی افراد همچنین دارای قد کوتاه و بدشکلی های مفصلی هستند که راه رفتن آنها را تحت تآثیر قرار می دهد. بسیاری از افراد مبتلا به نوع شدید بیماری دارای اختلالات متعدد استخوانی (دیزوستوز مالتبپلکس) هستند که از طریق رادیوگرافی قابل تشخیص هستند. در بسیاری از افراد مبتلا، سندروم کارپال تانل به وجود می آید که موجب کرخی، سوزش و ضعف در دستها و انگشتان می گردد. تنگ شدن کانال نخاعی ممکن است موجب فشار برروی نخاع وآسیب دیدگی آن شود. گرجه در هر دونوع بیماری بسیاری از اعضاء و بافتهای بدن فرد مبتلا درگیر می شوند، ولی در نوع ۱ ناتوانی ذهنی و پیشرفت سریع بیماری مطرح است. تاخیر رشد معمولآ تا یک سالگی مشهود است و افراد مبتلا به نوع شدید بیماری معمولآ مهارتهای اولیه خود را نیز از دست می دهند. طول عمر این بیماران معمولآ کوتاه است و در برخی موارد فقط تا اواخر کودکی زنده می مانند. در نوع خفیف بیماران تا سن بلوغ زنده می مانند و در بعضی موارد ناتوانی در یادگیری دارند در حالیکه بعضی دیگر ناتوانی ذهنی مشاهده نمی شود. بیماریهای قلبی و انسداد راههای هوایی عامل عمده مرگ و میر در افراد مبتلا به هردو نوع بیماری هستند.
میزان شیوع
نوع شدید بیماری از هر ۱۰۰ هزار نوزاد یک نفر را مبتلا می کند ولی نوع خفیف آن از شیوع کمتری برخوردار است (۱ در هر ۵۰۰ هزار نوزاد).
علت بیماری
جهش در ژن IDUA موجب ابتلاء به بیماری MPS1 می شود. ژن IDUA اطلاعات مورد نیاز برای ساخت آنزیمی را ارائه می کند که در شکستن مولکولهای بزرگ قندی به نام گلیکوزآمینو گلایکان ها به کار می رود. قبلآ این مولکول موکوپلی ساکارید خوانده می شد. جهش در ژن IDUA موجب کاهش عملکرد آنزیم ایدورونیداز یا فقدان کامل آن می شود. فقدان عملکرد آنزیم فوق موجب تجمع گلیکوزآمینو گلایکان درون سلولها بخصوص لیزوزومها می شود. لیزوزومها اجزاء درون سلولی هستند که موجب هضم و تصفیه مواد می شوند. به حالاتی نظیر MPSI که موجب انباشته شدن مولکولها درون لیزوزومها می شوند بیماریهای ذخیره ای لیزوزوم گفته می شود. تجمع گلیکوزآمینوگلایکان ها در داخل لیزوزوم منجر به بزرگ شدن آن می شود و همین مسئله علت بزرگ شدن بسیاری از بافتها و ارگانها در این بیماریها می باشد. محققین همچنین معتقدند گلیکوز آمینوگلایکان ها در عین حال موجب جلوگیری از نفوذ مولکولها به درون سلول می شوند.
توارث بیماری
این بیماری به صورت اتوزومی مغلوب به ارث می رسد. به این معنی که برای ابتلاء یک فرد باید هردو نسخه ژن مربوطه باید جهش یافته باشند. بنابراین والدین یک فرد مبتلا هردو ناقل هستند.
تشخیص و پیشگیری
در صورتی که تمام یا برخی از علائم بیماری که در بالا به آنها اشاره شد در فرزند، برادر یا خواهر هر یک از زوجین یا خویشاوندان نزدیک آنها مشاهده شود، انجام موارد زیر حد اقل ۴ تا ۶ ماه پیش از اقدام به بارداری، برای پیشگیری از وقوع مجدد بیماری ضروری خواهد بود :
-
مراجعه به مرکز ژنتیک پزشکی برای تشخیص بیماری و تطبیق نحوه انتقال آن در فامیل با الگوی وراثتی بیماری
-
تشخیص نوع جهش در ژن مسئول بیماری به یکی از روش های مولکولی در فرد مبتلای فامیل
-
تعیین وضعیت زوج از حیث ناقل بودن یا نبودن برای جهش تشخیص داده شده در فرد مبتلا.
-
درصورتی که زوج هردو ناقل ژن جهش یافته بیماری باشند احتمال تکرار آن در هر بارداری ۲۵ درصد خواهد بود. در این صورت تشخیص پیش از تولد در هر بارداری ضرورت خواهد داشت.
-
مراجعه برای نمونه گیری برای تشخیص پیش از تولد. از دو نوع نمونه برای تشخیص پیش از تولد استفاده می شود:
-
نمونه CVS (پرزهای جفتی) که در هفته ۱۲ بارداری انجام می گیرد
-
نمونه مایع آمنیوتیک که در هفته ۱۵ به بعد انجام می گیرد.
-
بیماری تای ساکس Tay Sachs disease
تای ساکس یک بیماری متابولیکی از گروه بیماریهای ذخیره لیزوزومی است. این بیماری نادر و توارثی است و مشخصه آن اختلالات عصبی است که در نتیجه مرگ سلولهای عصبی (نورونها) در مغز و طناب نخاعی (سیستم اعصاب مرکزی) به وجود می آید.
شایع ترین نوع این بیماری که با عنوان “تای ساکس دوران نوزادی شناخته می شود، در مراحل اولیه زندگی ظاهر می شود. افراد مبتلا معمولآ تا ۳ تا ۶ ماهگی بطور طبیعی رشد می کنند. طی این مدت، رشد آنها کند و عضلات حرکتی شان ضعیف می شوند. منحنی رشد اینگونه نوزادان رشد مورد انتظار را نشان نمی دهد و مهارت های کسب شده قبلی مثل غلط زدن، نشستن و خزیدن را نیز از دست می دهند. با پیشرفت بیماری، کودکان مبتلا انقباضات عضلانی غیر ارادی، تشنج، اختلالات بلع، نابینایی، ناشنوایی و ناتوانی ذهنی را تجربه می کنند. Cherry red spot که از طریق معاینه چشم قابل تشخیص است از مشخصه های این بیماری تلقی می شود. کودکان مبتلا به تای ساکس نوزادی اغلب تا اوایل کودکی زنده می مانند.
دو نوع دیگر از این بیماری، به نامهای تای ساکس نوجوانی (شروع علائم بین ۵ سال تا بلوغ) و دوران بلوغ (شروع علائم بعد از بلوغ) نیز وجود دارد. در هردو نوع علائم خفیف تر و متنوع تر از نوع نوزادی هستند. مهمترین علائم این دو نوع از بیماری عبارتند از: ضعف عضلانی، از بین رفتن هماهنگی عضلانی (آتاکسی)، مشکلات گفتاری و علائم روانی. شدت علائم فوق در نوع تای ساکس دوران بلوغ بسیار متفاوت تر می باشد.
ژن مسئول بیماری HEXA است. این ژن اطلاعات لازم برای ساختن یک بخش (زیر واحد آلفا) از نوعی آنزیم به نام بتا-هگزوزآمینیداز A را ارائه می کند. آنزیم فوق در لیزوزومها قرار دارد، جایی که وظیفه شکستن مواد سمی و دفع آنها از سلول را بر عهده دارد. درون لیزوزومها، آنزیم بتا-هگزوزآمینیداز A به شکستن نوعی چربی به نام گانگلیوزید GM2 که در غشاء سلولی یافت می شود کمک می نماید.
اشکال جهش یافته ژن HEXA توانایی آنزیم بتا-هگزوزآمینیداز A را در شکستن گانگلیوزید GM2 تحت تآثیر قرار می دهد. در نتیجه، جربی فوق بخصوص در سلولهای عصبی سیستم اعصاب مرکزی (نرونها) در حد سمی تجمع پیدا می کند. آسیب وارده در نتیجه گانگلیوزید GM2 موجب سوء عملکرد و در نهایت مرگ نرونها و بروز علائم و نشانه های بیماری می شود.
جهش هایی که موجب حذف یا کاهش شدید عملکرد آنزیم بتا-هگزوزآمینیدازA و شوند موجب ابتلاء به نوع نوزادی بیماری می شوند و جهش هایی که تاحدودی عملکرد آنزیم در نتیجه آنها باقی می ماند موجب انواع نوجوانی یا بلوغ بیماری می گردند.
به دلیل اینکه بیماری تای ساکس عملکرد آنزیمهای لیزوزومی را مختل می کند و باعث تجمع گانگلیوزید GM2 می گردد از این حالت گاهآ به عنوان بیماری ذخیره لیزوزومی یا گانگلیوزیدوز GM2نام برده می شود.
تشخیص و پیشگیری
در صورتی که تمام یا برخی از علائم بیماری که در بالا به آنها اشاره شد در فرزند، برادر یا خواهر هر یک از زوجین یا خویشاوندان نزدیک آنها مشاهده شود، انجام موارد زیر حد اقل ۴ تا ۶ ماه پیش از اقدام به بارداری، برای پیشگیری از وقوع مجدد بیماری ضروری خواهد بود :
-
مراجعه به مرکز ژنتیک پزشکی برای تشخیص بیماری و تطبیق نحوه انتقال آن در فامیل با الگوی وراثتی بیماری
-
تشخیص نوع جهش در ژن مسئول بیماری به یکی از روش های مولکولی در فرد مبتلای فامیل
-
تعیین وضعیت زوج از حیث ناقل بودن یا نبودن برای جهش تشخیص داده شده در فرد مبتلا.
-
درصورتی که زوج هردو ناقل ژن جهش یافته بیماری باشند احتمال تکرار آن در هر بارداری ۲۵ درصد خواهد بود. در این صورت تشخیص پیش از تولد در هر بارداری ضرورت خواهد داشت.
-
مراجعه برای نمونه گیری برای تشخیص پیش از تولد. از دو نوع نمونه برای تشخیص پیش از تولد استفاده می شود:
-
نمونه CVS (پرزهای جفتی) که در هفته ۱۲ بارداری انجام می گیرد
-
نمونه مایع آمنیوتیک که در هفته ۱۵ به بعد انجام می گیرد.
-

موکوپلی ساکاریدوزها Mucopolysaccharidosis (MPS)
موکوپلی ساکاریدوزها گروهی از بیماریهای ژنتیکی هستند که در آن بدن افراد مبتلا قادر به شکستن موکوپلی ساکاریدها (قندهای زنجیره بلندی که درهمه نقاط بدن وجود دارند) نیستند. در نتیجه مواد قندی فوق در سلولها، خون و بافت پیوندی تجمع پیدا می کنند و منجر به مشکلات گوناگون در فرد می شوند. هفت نوع متفاوت از این بیماری تاکنون شناسایی شده است. شدت وعلائم مربوط به هریک از انواع این بیماریها بطور قابل توجهی با هم متفاوت است. در حالت کلی بسیاری از افراد مبتلا در موقع تولد سالم به نظر می رسند و مرحله ای از رشد و نمو طبیعی را پشت سر می گذارند ولی به تدریج از نظر رشد فیزیکی و ذهنی دچار پس رفت می شوند. به مرور که بیماری پیشرفت می کند ظاهر بیمار، توانایی های فیزیکی اش، عملکرد بافتها و دستگاههای بدن و در بسیاری از موارد رشد ذهنی فرد تحت تآثیر قرار می گیرد. علت ژنتیکی انواع مختلف این گروه از بیماریها متفاوت است. بسیاری از آنها از توارث اتوزومی مغلوب تبعیت می کنند، اگرچه فقط یک نوع آن (نوع II) دارای توارث وابسته به X است. درمان این بیماریها بر اساس علائمی است که در هر فرد بروز می کند.
انواع موکوپلی ساکاریدوزها:
موکوپلی ساکاریدوز نوع I
موکوپلی ساکاریدوز نوع II
موکوپلی ساکاریدوز نوع III
موکوپلی ساکاریدوز نوع IV
موکوپلی ساکاریدوز نوع VI
موکوپلی ساکاریدوز نوع VII
موکوپلی ساکاریدوز نوع IX

نیمن پیک Niemann Pick disease
بیماری نیمن پیک حالتی است که در آن ارگانهای متعددی درگیر می شوند. این بیماری علائم گسترده ای دارد که از نظر شدت متفاوت هستند. بیماری نیمن پیک به چهار نوع اصلی تقسیم بندی می شود: نوع A، نوع B، نوع C1 و نوع C2.. این تقسیم بندی بر اساس علت ژنتیکی و علائم بالینی انجام می گیرد.
در نوزادان مبتلا به نوع A کبد و طحال اغلب تا ۳ ماهگی بزرگ می شود و افزایش وزن آنها مطابق انتظار پیش نمی رود. حرکات و واکنش کودکان مبتلا تا یک سالگی معمولآ نرمال به نظر می رسد ولی بعد از آن توانایی های ذهنی آنها به تدریج پس رفت می کند. کودکان مبتلا به نوع A همچنین آسیب های متعدد ریوی را تجربه می کنند که موجب عفونت های مکرر ریوی و در نهایت ناتوانی ریوی می شود. همه کودکان مبتلا درای نوعی مشکل بینایی به نام cherry- red spot هستند که از طریق معاینه چشم قابل تشخیص است. این کودکان معمولآ تا اوایل کودکی زنده می مانند.
نیمن پیک نوع B معمولآ در اواسط دوران کودکی خود را نشان می دهد. علائم و نشانه های بیماری شبیه به نوع A می باشد ولی نه به شدت آن. این افراد معمولآ دارای بزرگی کبد و طحال هستند، عفونت های مکرر ریوی دارند و تعداد پلاکت های آنها در جریان خون پایین است (ترومبوسیتوپنی). همچنین قد آنها کوتاه است و سن استخوانی آنها با تآخیر همراه است. حدود یک سوم افراد مبتلا علامت چشمی cherry- red spot و مشکل عصبی و ذهنی را نشان می دهند. این افراد معمولآ تا سن بلوغ زنده می مانند.
علائم و نشانه های بیماری نیمن پیک نوع C1 و C2 خیلی شبیه به هم هستند. این دو نوع فقط از نظر علت ژنتیکی با هم فرق دارند. سن شروع آنها اغلب دوران کودکی است، اگرچه در هر زمانی ممکن است علائم بروز کنند. این افراد در انجام حرکات هماهنگ مشکل دارند (آتاکسی دارند) و ناتوانی در حرکت دادن عمودی چشم ها، اسپاسم عضلات، نارسایی شدید کبدی و فیبروزه شدن بافت ریه (Interstitial lung disease)، مشکل صحبت کردن و بلغ که به مرور بدتر می شود و موجب سوء تغذیه می گردد، کاهش توانایی های هوشی از دیگر علائمی است که در این افراد دیده می شود. حدود یک سوم افراد مبتلا دارای تشنج هستند. این افراد معمولآ تا سن بلوغ زنده می مانند.
شیوع بیماری
انواع A و B تخمین زده می شود از هر ۲۵۰۰۰۰ نفر یک نفر را مبتلا می کند. نوع A عمدتآ در جمعت اروپایی و یهودیان بیشتر دیده می شود. فراوانی آن در جمعیت های فوق ۱ در هر ۴۰۰۰۰ است.
میزان شیوع انواع C1 و C2 روی هم ۱ در هر ۱۵۰۰۰۰ است، ولی نوع C1 حدود ۹۵ در صد افراد مبتلا را شامل می شود و بیشتر در جمعیت فرانسوی را تحت تآثیر قرار می دهد.
علت ژنتیکی بیماری
نیمن پیک A و B در نتیجه وقوع جهش در ژن SMPD1 به وجود می آید. این ژن آنزیمی به نام اسید اسفنگومیلیناز را می سازد که در لیزوزومها یافت می شود. لیزوزومها اجزای داخل سلولی هستند که تجزیه انواع مختلفی از مولکولها و دفع مواد را بر عهده دارند. اسید اسفنگومیلیناز مسئول تبدیل نوعی چربی به نام اسفنگومیلین به نوعی چربی دیگر به نام سرامید است. موتاسیون در SMPD1 موجب کاهش میزان آنزیم اسفنگومیلیناز و کاهش میزان تبدیل اسفنگومیلین به سرامید می شود. در نتیجه چربی فوق در سلولها تجمع پیدا کرده و موجب عملکرد غیر طبیعی و در نهایت مرگ آنها می شود. به تدریج مرگ سلولها باعث اختلال درعملکرد بافتها و ارگانهایی مثل مغز، ریه، طحال و کبد در افراد مبتلا به بیماری نیمن پیک نوع A و B می شود.
موتاسیون در هر یک از ژنهای NPC1 یا NPC2 علت ابتلاء به نیمن پیک نوع C است. پروتئین هایی که توسط این دو ژن ساخته می شوند در حرکت چربی ها درون سلولها نقش دارند. جهش در این ژنها موجب کاهش میزان پروتئین های فعال و بروز اختلال در حرکت کلسترول و سایر چربی ها و در نهایت تجمع آنها درون سلولها می شود. به دلیل اینکه چربی ها در محل مناسب خود در سلول قرار ندارند، بسیاری از عملکردهای طبیعی سلولها که به چربی نیاز دارند (مانند ساختن غشاء سلولی) مختل می شوند. تجمع چربی ها و همچنین سوء عملکرد سلول در نهایت منجر به مرگ سلولی و آسیب دیدن بافت ها و ارگانهایی شود که در نیمن پیک نوع C1 و C2 دیده می شود.
تشخیص و پیشگیری
در صورتی که تمام یا برخی از علائم بیماری که در بالا به آنها اشاره شد در فرزند، برادر یا خواهر هر یک از زوجین یا خویشاوندان نزدیک آنها مشاهده شود، انجام موارد زیر حد اقل ۴ تا ۶ ماه پیش از اقدام به بارداری، برای پیشگیری از وقوع مجدد بیماری ضروری خواهد بود :
-
مراجعه به مرکز ژنتیک پزشکی برای تشخیص بیماری و تطبیق نحوه انتقال آن در فامیل با الگوی وراثتی بیماری
-
تشخیص نوع جهش در ژن مسئول بیماری به یکی از روش های مولکولی در فرد مبتلای فامیل
-
تعیین وضعیت زوج از حیث ناقل بودن یا نبودن برای جهش تشخیص داده شده در فرد مبتلا.
-
درصورتی که زوج هردو ناقل ژن جهش یافته بیماری باشند احتمال تکرار آن در هر بارداری ۲۵ درصد خواهد بود. در این صورت تشخیص پیش از تولد در هر بارداری ضرورت خواهد داشت.
-
مراجعه برای نمونه گیری برای تشخیص پیش از تولد. از دو نوع نمونه برای تشخیص پیش از تولد استفاده می شود:
-
نمونه CVS (پرزهای جفتی) که در هفته ۱۲ بارداری انجام می گیرد
-
نمونه مایع آمنیوتیک که در هفته ۱۵ به بعد انجام می گیرد.
-


هیپر پلازی مادرزادی آدرنال (Congenital Adrenal Hyperplasia (CAH
هیپرپلازی مادرزادی آدرنال
نقص در ساخته شدن آنزیم ۲۱-هیدروکسیلاز مسئول حدود ۹۵ درصد بیماری هیپرپلازی مادرزادی آدرنال است. این گروه از بیماری های ژنتیکی، غدد آدرنال را تحت تآثیر قرار می دهند. غدد آدرنال در قسمت فوقانی کلیه ها قرار دارند و گروهی از هورمونها را می سازند که تنظیم برخی از فرایند های اساسی در بدن را بر عهده دارند. در افرادی که نثص در سنتز ۲۱-هیدروکسیلاز دارند ساخته شدن آندروژنها که هورمونهای جنسی مردانه محسوب می شوند بیش از حد طبیعی است.
سه نوع از هیپرپلازی مادرزادی آدرنال وجود دارد. دو نوع از آنها حالت کلاسیک دارند که اولی شدید است و همراه با دفع نمک در ادرار است و نوع دوم همراه با بروز علائم مردانگی می شود و در مقایسه با نوع اول علائم خفیف تری دارد. نوع سوم غیر کلاسیک است و خفیف ترین شکل بیماری را دارد.
مردان و زنان مبتلا به انواع کلاسیک بیماری دارای رشد جهشی در اوایل دوران بلوغ هستند ولی طول قد آنها در نهایت کوتاهتر از سایر افراد فامیل است. بعلاوه، امکان صاحب فرزند شدن این افراد کم است. همچنین رویش موی اضافی در بدن، طاسی سر شبیه مردان و پریود نامنظم ازعلائم این بیماری در زنان مبتلا است .
تقریبآ ۷۱ درصد افراد مبتلا به نوع کلاسیک، به نوع اول (همراه با دفع نمک) بیماری مبتلا هستند. تولید هورمون در این نوع از بیماری به شدت پایین است. افراد مبتلا مقادیر زیادی از سدیم را از طریق ادرار دفع می نمایند که ممکن است در دوران نوزادی کشنده باشد. نوزادان مبتلا به این نوع بیماری ممکن است سوء تغذیه، کاهش وزن از داست دادن آب بدن و استفراغ را تجربه کنند. در نوع دوم (همراه با علائم مردانگی) کاهش نمک بدن اتفاق نمی افتد.
اندام تناسلی خارجی زنان مبتلا به انواع کلاسیک بیماری، به هیچیک از اشکال زنانه یا مردانه شبیه نیست (ابهام در اندام تناسلی خارجی). مردان دارای اندام تناسلی نرمال هستند ولی بیضه در آنها کوچک است.
زنان مبتلا به نوع غیر کلاسیک بیماری دارای اندام جنسی نرمال هستند. با افزایش سن در این افراد ممکن است علائمی مانند پرموئی، طاسی شبیه مردان، پریود نامنظم و کاهش قدرت باروری ظاهر شود. در مردان مبتلا به نوع غیر کلاسیک بیماری، ممکن است رویش ریش زودرس و بیضه کوچک دیده شود. برخی از افراد مبتلا به این نوع از بیماری ممکن است هیچیک از علائم بیماری را بروز ندهند.
میزان شیوع
نوع کلاسیک بیماری از هر ۱۵۰۰۰ نفر یک نفر را مبتلا می کند. میزان شیوع نوع غیر کلاسیک بیماری ۱ در هر ۱۰۰۰ تخمین زده می شود. شیوع بیماری بر حسب نوع نژاد و منطقه جغرافیایی متفاوت است.
علت ژنتیکی بیماری
جهش در ژن CYP21A2 عامل بیماری است. ژن فوق اطلاعات لازم برای ساخت آنزیمی بنام ۲۱-هیدروکسیلاز را ارائه می دهد. این آنزیم در غدد آدرنال یافت می شود، جایی که آنزیم در آن نقش مهمی را در تولید هورمونهای کورتیزول و آلدسترون ایفا می کند . کورتیزول دارای چند عملکرد است، از آن جمله تنظیم قند خون، محافظت از بدن در مقابل استرس و مهار التهاب. آلدسترون گاهآ هورمون محافظت کننده نمک خوانده می شود چرا که میزان ابقاء نمک در بدن را تنظیم می کند. میزان نمک در بدن سطوح مایعات بدن و فشار خون را تحت تآثیر قرار می دهد.
بیماری هیپرپلازی مادرزادی آدرنال در نتجه نقصان یا کاهش آنزیم ۲۱- هیدروکسیلاز به وجود می آید. در فقدان این آنزیم، موادی که باید کورتیزول و آلدسترون را تولید کنند در غدد آدرنال تجمع پیدا کرده و به آندروژنها تبدیل می شوند. افزایش میزان آندروژنها موجب بروز اختلال در نمو جنسی افراد مبتلا به نقص ۲۱- هیدروکسیلاز می شود. فقدان آلدسترون به دفع نمک در افراد مبتلا به بیماری نوع کلاسیک همراه با هدر رفت نمک منجر می شود.
مقدار آنزیم فعال شدت بیماری را مشخص می کند. افرادی که به نوع دفع نمک بیماری مبتلا هستند دارای جهشی در ژن CYP21A2 هستند که در آن آنزیم تولید شده کاملا غیر فعال است. در افرادی که به نوع خفیف تر بیماری مبتلا هستند (همراه علائم مردانگی) مقادیر کمی از آنزیم فعال تولید می شود و در نوع غیر کلاسیک بیماری، تولید آنزیم فعال در مقایسه با دو نوع قبلی بیشتر ولی نسبت به افراد نرمال کمتر می باشد.
توارث بیماری
این بیماری به صورت اتوزومی مغلوب به ارث می رسد به این معنی که هردو نسخه ژن در افراد مبتلا حالت جهش یافته دارند. در این صورت والدین یک فرد مبتلا هردو ناقل اند ولی هردو فاقد علائم بالینی هستند.
تشخیص و پیشگیری
در صورتی که تمام یا برخی از علائم بیماری که در بالا به آنها اشاره شد در فرزند، برادر یا خواهر هر یک از زوجین یا خویشاوندان نزدیک آنها مشاهده شود، انجام موارد زیر حد اقل ۴ تا ۶ ماه پیش از اقدام به بارداری، برای پیشگیری از وقوع مجدد بیماری ضروری خواهد بود :
-
مراجعه به مرکز ژنتیک پزشکی برای تشخیص بیماری و تطبیق نحوه انتقال آن در فامیل با الگوی وراثتی بیماری
-
تشخیص نوع جهش در ژن مسئول بیماری به یکی از روش های مولکولی در فرد مبتلای فامیل
-
تعیین وضعیت زوج از حیث ناقل بودن یا نبودن برای جهش تشخیص داده شده در فرد مبتلا.
-
درصورتی که زوج هردو ناقل ژن جهش یافته بیماری باشند احتمال تکرار آن در هر بارداری ۲۵ درصد خواهد بود. در این صورت تشخیص پیش از تولد در هر بارداری ضرورت خواهد داشت.
-
مراجعه برای نمونه گیری برای تشخیص پیش از تولد. از دو نوع نمونه برای تشخیص پیش از تولد استفاده می شود:
-
نمونه CVS (پرزهای جفتی) که در هفته ۱۲ بارداری انجام می گیرد
-
نمونه مایع آمنیوتیک که در هفته ۱۵ به بعد انجام می گیرد.
-
در این آزمایشگاه کلیه ۱۰ اگزون ژن CYP21A2 به همراه نواحی مرزی بین اینترون و اگزون به روش PCR و Direct Sequencing به صورت پیش و بعد از تولد مورد بررسی قرار می گیرند.

آلبینیسم چشمی – پوستی Oculo – Cataneous Albinism
آلبینیسم چشمی – پوستی به گروهی ار بیماریها اطلاق می شود که رنگ پوست، مو و چشم را تحت تآثیر قرار می دهند. افراد مبتلا معمولآ دارای پوست نازک و موهای سفید یا روشن هستند . تابش طولانی مدت نورآفتاب خطر آسیب های پوستی و سرطانT به خصوص نوع خطرناکی از سرطان پوست به نام ملانوما را در این افراد افزایش می دهد. آلبینیسم چشمی – پوستی همچنین موجب کاهش رنگدانه های بخش رنگی چشم (عنبیه) و ناحیه حساس به نور واقع در قسمت خلفی چشم (شبکیه) می شود. افراد مبتلا به این بیماری معمولآ مشکلات بینایی از جمله وضوح کم تصاویر، حرکت غیر ارادی کره چشم (نیستاگموس) و حساسیت زیاد به به نور (فتو فوبی) دارند.
انواع متفاوتی ازآلبینیسم چشمی – پوستی شناسایی شده است که بر اساس رنگ پوست، مو، چشم و نوع ژن مسئول از همدیگر متمایز می شوند. نوع ۱ موجب موی سفید، پوست بسیار کم رنگ و رنگ عنبیه روشن می شود. نوع ۲ در مقایسه با نوع ۱ دارای علائم خفیف تر است. پوست معمولآ به رنگ سفید کرمی و رنگ موها زرد روشن، بلوند یا قهوه ای روشن است. نوع ۳ اغلب رنگین پوستان را تحت تآثیر قرار می دهد. مبتلایان به این نوع از آلبینیسم، پوستی قهوه ای رنگ متمایل به قرمز، موی قرمز و عنبیه قهوه ای رنگ دارند. اختلالات بینایی در نوع ۳ آلبینیسم اغلب خفیف تر از سایر انوع آن است. نوع ۴ علائمی شبیه نوع ۲ دارد.
انواع دیگری از این بیماری نیز گزارش شده است که هر کدام در یک یا چند خانواده معدود دیده شده است.
میزان شیوع بیماری
بیماری آلبینیسم چشمی – پوستی تقریبآ از هر ۲۰ هزار فرد یک فرد را در جمعیت جهانی مبتلا می کند. نوع ۱ و ۲ شایعترین نوع این بیماری است. نوع ۳ و ۴ از شیوع کمتری برخوردار است. نوع ۲ عمدتآ در جمعیت آمریکایی – آفریقایی، نوع ۳ اغلب در جمعیت آفریقای جنوبی و نوع ۴ در ژاپنی ها و کره ای ها مشاهده می شود.
ژنهای مسئول بیماری
آلبینیسم چشمی – پوستی در اثر وقوع جهش در چندین نوع ژن ممکن است اتفاق بیافتد: نوع یک نتیجه تغییر در ژن TYR، نوع ۲ نتیجه تغییر در OCA2، نوع ۳ نتیجه جهش در TYRP1 و نوع ۴ نتیجه موتاسیون در SLC45A2 می باشد.
نحوه توارث بیماری آلبینیسم چشمی – پوستی
این بیماری به صورت اتوزومی مغلوب به ارث می رسد، به این معنی که افراد مبتلا اغلب دارای والدین سالم ولی ناقل ژن بیماریزا هستند.
تشخیص و پیشگیری
در صورتی که تمام یا برخی از علائم بیماری که در بالا به آنها اشاره شد، در فرزند، برادر یا خواهر هر یک از زوجین یا خویشاوندان نزدیک آنها مشاهده شود، انجام موارد زیر حد اقل ۴ تا ۶ ماه پیش از اقدام به بارداری، برای پیشگیری از وقوع مجدد بیماری ضروری خواهد بود :
-
مراجعه به مرکز ژنتیک پزشکی برای تشخیص بیماری و تطبیق نحوه انتقال آن در فامیل با الگوی وراثتی بیماری
-
تشخیص نوع جهش در ژن مسئول بیماری به یکی از روش های مولکولی در فرد مبتلای فامیل
-
تعیین وضعیت زوج از حیث ناقل بودن یا نبودن برای جهش تشخیص داده شده در فرد مبتلا.
-
درصورتی که زوج هردو ناقل ژن جهش یافته بیماری باشند احتمال تکرار آن در هر بارداری ۲۵ درصد خواهد بود. در این صورت تشخیص پیش از تولد در هر بارداری ضرورت خواهد داشت.
-
مراجعه برای نمونه گیری برای تشخیص پیش از تولد. از دو نوع نمونه برای تشخیص پیش از تولد استفاده می شود:
-
نمونه CVS (پرزهای جفتی) که در هفته ۱۲ بارداری انجام می گیرد
-
نمونه مایع آمنیوتیک که در هفته ۱۵ به بعد انجام می گیرد.
-
